Vaccino Pfizer, le verità del bugiardino: benefici, dubbi ed effetti collaterali
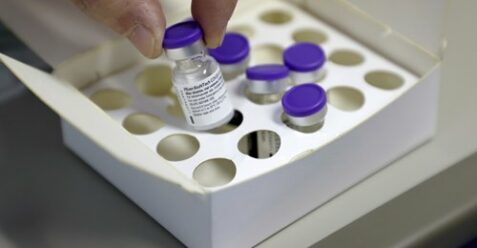
Ci sono buone notizie e alcune zone grige nel documento di 34 pagine dove si racconta ciò che ufficialmente si sa di Comirnaty, il vaccino del consorzio statunitense-tedesco Pfizer/BionTech le cui prime dosi, distribuite in quantitativi simbolici, iniziano a essere somministrate oggi in Italia. L’Ema, l’Agenzia europea per i medicinali, ha infatti appena autorizzato la traduzione in italiano del «Riassunto delle caratteristiche del prodotto», del «Foglio illustrativo» (alias bugiardino) e del resto della documentazione relativa al siero. Simili certificazioni sono sempre “prudenziali”. Pure quelle dei normali farmaci da banco sembrano fatte apposta per spaventare le persone, e in un certo senso è proprio così: sono gli stessi studi legali delle case farmaceutiche a consigliare un tale approccio, in modo che nessuno possa poi dire di non essere stato avvisato. Stavolta, però, siamo davanti a un prodotto nuovo, non ancora testato su un’ampia popolazione e per un lungo periodo di tempo. E proprio l’incertezza su alcuni aspetti importanti è ciò che più colpisce nella lettura di quelle pagine.
Cominciando da una delle caratteristiche principali, ossia il periodo di immunizzazione. «La durata della protezione offerta dal vaccino non è nota; sono tuttora in corso studi clinici volti a stabilirla», avverte il documento. Ne sapremo di più tra qualche tempo. In ogni caso, «come per tutti i vaccini, la vaccinazione con Comirnaty potrebbe non proteggere tutti coloro che lo ricevono. I soggetti potrebbero non essere completamente protetti fino a 7 giorni dopo la seconda dose del vaccino». Sulla carta si tratta comunque del vaccino migliore tra i sei trattati dall’Unione europea. Trascorsa una settimana dalla somministrazione della seconda dose, che deve avvenire «almeno 21 giorni» dopo la prima iniezione, l’efficacia del siero «è risultata pari al 94,6%». Sinora un livello analogo di protezione si riscontra solo nel siero di Moderna, altra azienda statunitense, che dovrebbe essere autorizzato dall’Ema il 6 gennaio.
Altro terreno inesplorato è quello degli effetti sulla cosiddetta “popolazione pediatrica”. «La sicurezza e l’efficacia di Comirnaty nei bambini e negli adolescenti di età inferiore a 16 anni non sono state ancora stabilite. I dati disponibili sono limitati». Motivo per cui, avvisa il foglio illustrativo, «Comirnaty non è raccomandato nei bambini di età inferiore a 16 anni». Riguardo alle donne incinte e alle puerpere il discorso è ancora più delicato. Dal documento si apprende infatti che, a causa dei pochi casi studiati sinora, «non sono disponibili dati su Comirnaty relativi al trasferimento placentare o all’escrezione nel latte materno del vaccino». E tranquillizza solo fino a un certo punto leggere che negli studi compiuti sui ratti «non si sono verificati effetti correlati al vaccino in termini di fertilità nelle femmine, gravidanza, sviluppo embrionale/fetale o sviluppo della prole». Le signore sono dunque avvisate: «Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno chieda consiglio al medico o al farmacista prima di ricevere questo vaccino». Capitolo a parte quello dedicato alle «reazioni avverse». Tra le conseguenze classificate come «molto comuni», ovvero riscontrate in più del dieci per cento dei soggetti cui è stato somministrato il vaccino, appaiono la normale cefalea, stanchezza, brividi, dolori ai muscoli o alle articolazioni. Meno comuni la nausea (in percentuale tra l’1 e il 10%) e, con un’incidenza inferiore all’1%, i casi di insonnia.
Ci sono stati anche casi di «anafilassi», termine che indica una grave reazione allergica. La loro frequenza è definita come «non nota», in quanto impossibile da stimare «sulla base dei dati disponibili». Anche per questo, il documento prevede che siano resi «sempre immediatamente disponibili trattamento e assistenza medica adeguati nel caso di comparsa di una reazione anafilattica in seguito alla somministrazione del vaccino». Dopo la vaccinazione si raccomanda «un attento monitoraggio» del paziente «per almeno 15 minuti», e ovviamente è vietato somministrare la seconda dose di Comirnaty a soggetti che abbiano manifestato una simile reazione dopo la prima iniezione. Quattro soggetti, su un totale dei 21.744 che hanno partecipato agli studi clinici di questo vaccino, hanno poi riscontrato «paralisi facciale periferica acuta», anche con notevole ritardo rispetto all’iniezione. Questo è avvenuto 37 giorni dopo la prima dose (il partecipante non ha ricevuto la seconda dose), e 3, 9 e 48 giorni dopo la seconda dose. La reazione è classificata come «rara», interessando meno di una persona di mille, ed è stata sempre «temporanea». Sull’argomento, però, c’è ancora da scrivere e capire. Tant’ è che Comirnaty è sottoposto a «monitoraggio addizionale», una sorta di sorveglianza speciale, e agli operatori sanitari è «richiesto di segnalare qualsiasi reazione avversa sospetta» attraverso un apposito sistema nazionale.